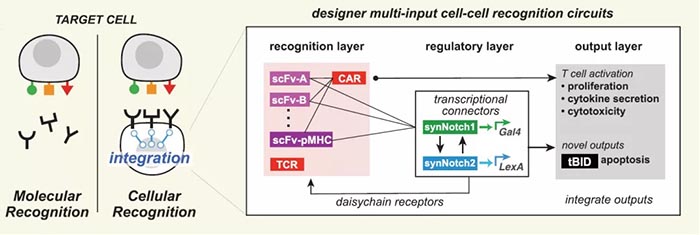
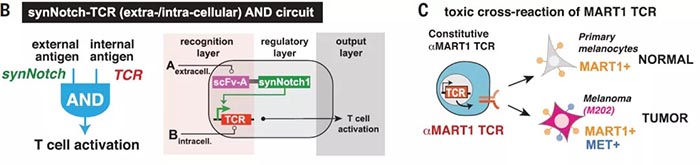
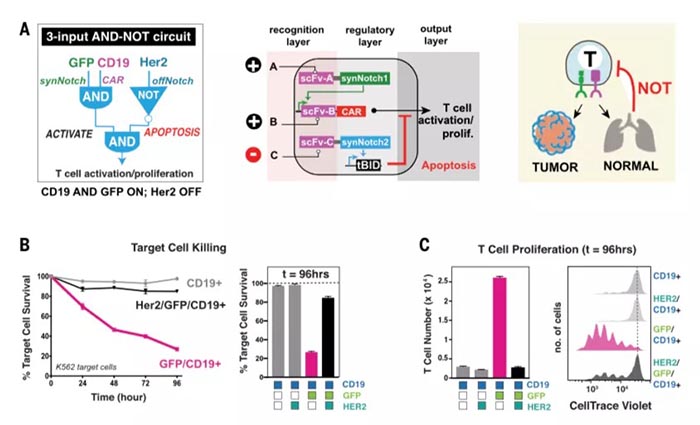
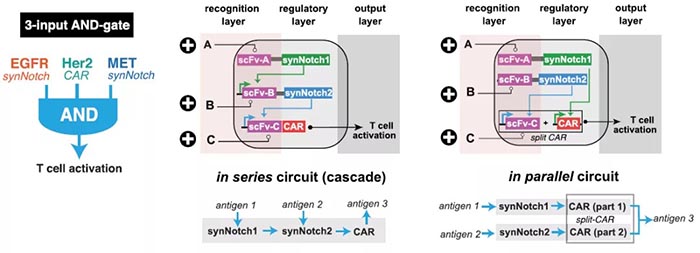
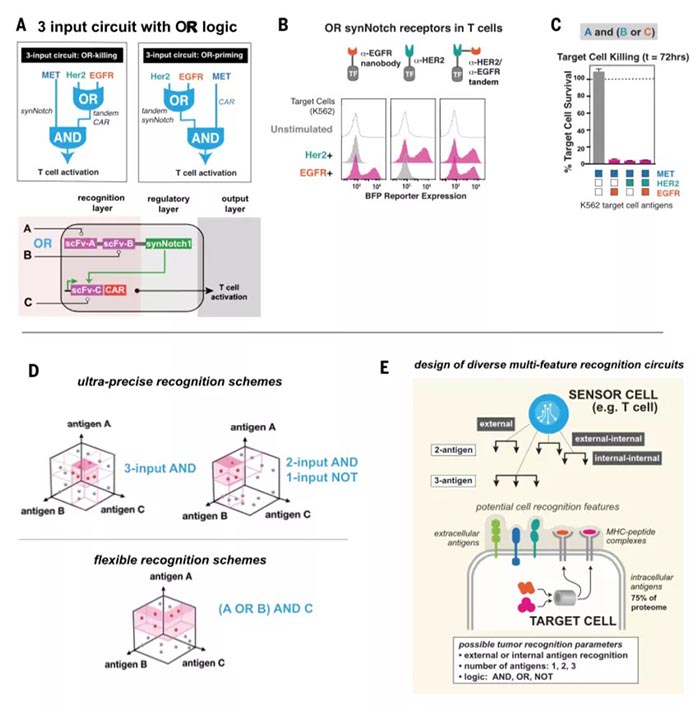
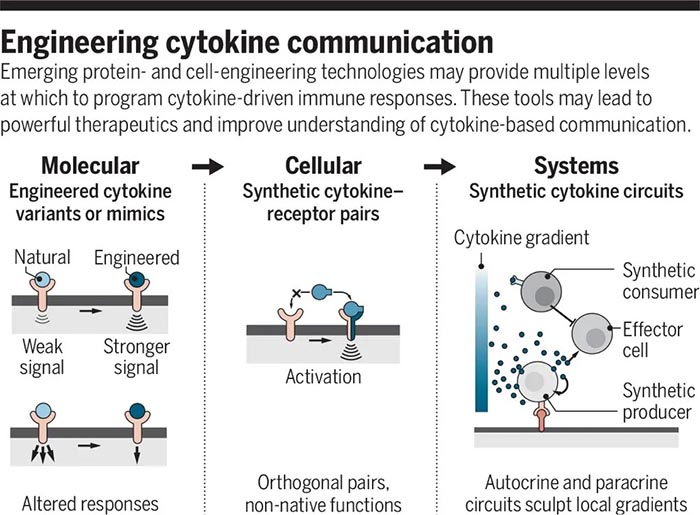
精确的细胞与细胞间识别在生物学中至关重要,其识别的精确性主要由多种表面受体介导,综合调控发挥作用【1】。精确的细胞识别过程也是治疗癌症等疾病的重要靶点,但目前的治疗方法(如抗体、嵌合抗原受体(CARs)等)主要依赖于通过与单一癌症相关抗原的相互作用来识别恶性细胞,但大多数癌细胞缺乏单一抗原【2】,所以效果有限。CAR T细胞已在临床试验中发现可以与正常组织发生交叉反应【3】,原因是很多正常的上皮组织中也存在CAR 抗原靶点。但生物信息学分析表明,组合抗原可以增加靶细胞识别的特异性【4】。工程化细胞疗法是构建组合识别程序的适宜平台,多分子识别系统可以通过协调的细胞内调控组装,生成更高阶的细胞识别程序。加州大学旧金山分校Wendell Lim团队此前设计并合成了Notch(synNotch)受体【5】,通过将抗原识别域(如单链抗体(scFv)等)与转录调控域相连接,使得只有与特定目标抗原结合时,才会诱导指定基因编码表达。并成功使用synNotch受体驱动CAR表达,通过双抗原 “AND”门,实现T细胞对表达双抗原靶细胞的精确杀伤【6】。图1. SynNotch能以菊花链的方式链接多个受体系统,形成多样化细胞间识别回路近日,Wendell Lim团队在Science上在线了题为“Precise T cell recognition programs designed by transcriptionally linking multiple receptors”的研究论文,继续使用多个synNotch受体作为灵活的调节连接器,通过菊花链(daisy-chained)等方式链接在一起,形成一个具有精确的输入和输出功能的广谱受体,实现了更完整的细胞与细胞间的识别行为。研究人员首先对比了来自53个人类黑色素瘤细胞系RNA测序数据,发现与正常的黑色素细胞相比,黑色素瘤系过度表达表面抗原MET(肝细胞生长因子受体),因此,研究人员利用胞内黑色素细胞抗原MART1和MET,通过构建抗MET synNotch → 抗MART1的TCR回路用以区分黑色素瘤细胞和正常黑色素细胞。结果显示CD8+ T细胞特异性对MET+/MART1+ 肿瘤细胞表现出增殖和细胞毒性特征,表明synNotch → TCR回路可以稳定发挥作用,并证明了抗pMHC的scFv可以作为synNotch(inNotch)受体的识别头。图2 抗MET synNotch → 抗MART1的TCR回路用以区分黑色素瘤细胞和正常黑色素细胞这种组合识别策略也可以添加阴性抗原,即“NOT”门,抗原在正常组织中表达而不在靶癌细胞中表达。研究人员构建了一个激活促凋亡因子tBID表达的synNotch回路,称之为OFF-Notch,受到刺激时迅速诱导T细胞凋亡,从而抑制CAR T细胞对靶细胞的杀伤功能,防止交叉反应。研究人员进一步建立了两个具有不同转录调控域的正交synNotch平台,包含“AND”门和“NOT”门三抗原,将抗HER2的“NOT”门与抗GFP和CD19的“AND”门相结合,在不同HER2、GFP和CD19表达模式的K562细胞混合池中加入表达该回路的CD8+ T细胞,发现只有那些表达GFP、CD19和NOT HER2抗原组合的靶细胞被杀死。GFP+/CD19+ 肿瘤细胞诱导了T细胞扩增,但这种增殖被同时表达HER2的靶细胞显著阻断。图3. 通过正负逻辑门,使用synNotch模块驱动激活和凋亡输出除了“AND”门联合“NOT”门外,研究人员也证明了多个“AND”门结合(CAR识别第三种抗原),有两种方式,类似于电路中的串联(synNotch A诱导synNotch B的表达,而synNotch B又诱导CAR C的表达)和并联(synNotch A诱导CAR第1部分的表达,而synNotch B诱导CAR第2部分的表达)。在体外试验中,串联效果和输出信号强→弱级联传递时效果相对更好,并在表达不同受体的K562肿瘤细胞移植的小鼠体内实验得到验证。此外,“OR”门的杀伤功能也可以通过synNotch受体诱导串联CAR表达来实现,研究人员成功验证了靶向EGFR和HER2的功能。并将“OR”门联合“AND”门,纳入一个三抗原的回路(串联synNotch → MET CAR)中发现,产生的T细胞能够有效杀伤表达MET与EGFR或HER2结合的靶细胞。图5. 利用synNotch集成回路提供多样化的细胞间识别策略总的来说,该研究通过使用synNotch受体转录互联多个分子识别事件,设计了一个多样化的多受体细胞与细胞间识别回路库,工程化的T细胞可以通过AND/OR/NOT门整合细胞外和细胞内的多个抗原识别信息,以实现对靶细胞更精确更强大的识别功能。值得注意的是,2020年9月23日,Wendell Lim团队和普林斯顿大学Olga Troyanskaya团队在Cell System上在线了另一项研究,通过机器学习分析了癌症细胞和正常细胞中的数千种蛋白数据,筛选数百万种可能的蛋白组合以精确靶向癌细胞【7】。Wendell Lim同时在Science上在线了一篇观点文章:“Engineering cytokines and cytokine circuits”,通过对细胞因子调节进行编程,实现对其在时空上的精密控制,有利于基于细胞因子的癌症和其他疾病的治疗作用。如IL-2已被FDA批准用于治疗黑色素瘤和其他癌症等等,但IL-2临床上半衰期较短(血清半衰期为90分钟),高剂量的IL-2才能达到治疗效果,但高剂量IL-2同时会靶向健康器官从而引起全身毒性。此外,IL-2还能靶向多种免疫细胞具有多种功能。通过工程化改造,如将IL-2附着在聚乙二醇(PEG)等基团上,可以延长血清半衰期,PEG化的IL-2作为原药通过阻碍受体结合来减轻给药后的快速全身激活,PEG释放后,游离的IL-2便随着时间的推移而功能化可利用,但这些方法并不能充分解决全身毒性和多靶向的主要问题。而更加精细的蛋白质工程和细胞工程可以在多层次上对细胞因子驱动的免疫反应的时间和空间进行编程,如一种通过设计增加了对IL-2Rβ的结合亲和力的名为“Super2”的IL-2拮抗剂,更倾向启动低表达具有IL-2-IL-2Rβ稳定作用的IL-2Rα的初始T细胞;此外,可以仅激活IL-2和IL-15受体共享链的工程化细胞因为“neo-2/15”和对内源性IL-18拮抗剂不敏感的细胞因子“DR-18”均有一定的抗肿瘤益处。工程化“受体对”如IL-2/IL-2R(分别为ortho2和ortho2R)可以更加特异性的精确控制靶细胞增殖,该概念也在CAR T细胞等领域具有重大潜力。而如synNotch受体一般的模块化传感受体,则可用于精确调控细胞因子,以响应局部疾病或组织抗原信号,具有高度局部化可编程的潜力。这种工程化的细胞递送系统提供了一种绝佳的精确靶向和调控局部疾病环境的可能,可用以驱动抗肿瘤反应以及重塑免疫抑制反应,尤其是与工程化的自分泌或旁分泌信号相结合,可以通过正反馈局部放大活性。这种回路特异性高、却具有局部化和组织特异性等特点,也能有效减少脱靶效应,因此该策略可能对治疗其他涉及炎症失衡的疾病,如自身免疫、纤维化、组织或伤口再生等具有广泛影响,目前仍在验证之中。https://science.sciencemag.org/content/370/6520/1099https://science.sciencemag.org/content/370/6520/10341. E. O. Long, H. S. Kim, D. Liu, M. E.Peterson, S. Rajagopalan, Annu. Rev. Immunol. 31, 227–258 (2013).2. C. A. Klebanoff, S. A. Rosenberg, N. P.Restifo, Nat. Med. 22, 26–36 (2016).3. R. A. Morgan et al., Mol. Ther. 18,843–851 (2010).4. F. Perna et al., Cancer Cell 32,506–519.e5 (2017).5. L. Morsut et al., Cell 164, 780–791(2016).6. K. T. Roybal et al., Cell 164, 770–779(2016).7. D. Ruth et al., Cell Syst 11, 215-228.e5(2020).